Nat Commun丨纤维素纳米纤维纸用于空间外泌体分析
细胞外囊泡(EVs),包括外泌体,在参与疾病机制方面被认为是有前途的功能靶点。然而,EVs的体内异质性仍然不清楚,而分析EVs的主要限制在于需要一定量的生物流体。来自日本名古屋大学的研究人员提出使用纤维素纳米纤维(CNF)纸来解决这些问题。他们发现,CNF纸可以从极小的生物流体样本中捕获和保留EVs,并且能够分析EVs内的生物活性分子(如miRNA),并在卵巢癌小鼠和患者中进行了验证,揭示EV miRNA谱中存在位置的差异性。这项技术有望为我们提供有关EV生物学的新见解,并为癌症诊断、分期评估和治疗规划提供临床策略。相关内容以“Spatial exosome analysis using cellulose nanofiber sheets reveals the location heterogeneity of extracellular vesicles”为题在线发表于11月8日的国际综合性学术期刊Nature Communications上。
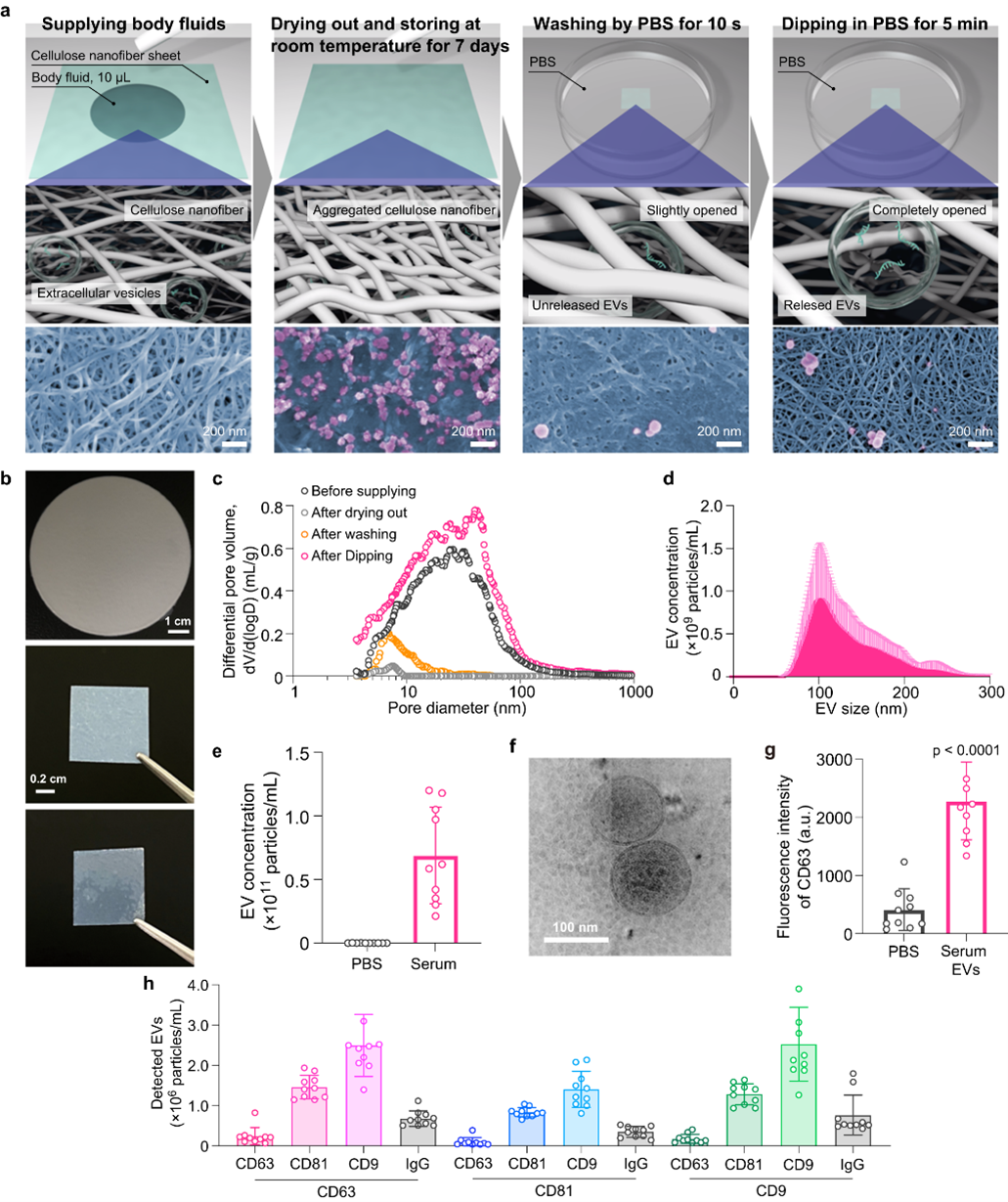
细胞外囊泡(EVs),包括外泌体,是从所有活细胞分泌,在细胞间通信中发挥着重要作用。EVs的生物特性可能反映了它们的细胞起源、功能和生物发生过程,因此,体液中的EVs可能反映了各种组织中细胞产生的总EV多样性。就人体而言,有许多类型的液体携带EVs,而EV的异质性可能会更加复杂。在肿瘤生物学中,肿瘤微环境中的细胞异质性已经得到广泛认可,近几十年来已经设计了许多研究来解决这一复杂性。阐明EV的亚群现在也是一项重要任务,但由于EVs在体液中不断循环,实际上无法研究人体内的EV异质性。一般来说,许多患有实体肿瘤的癌症患者,如胃肠或妇科癌症,肿瘤位于腹腔,而在某些情况下,这些患者体内会积聚恶性腹水。腹水中的EVs在肿瘤进展或免疫维持中具有多种功能,它们应该是开发治疗策略的关键目标。从理论上看,靠近原发肿瘤、肝脏表面或盆腔的腹水中的各类EV可能具有不同的分子特征,这种基于位置的异质性尚未得到研究。这需要创新一种新的方法去研究,因为没有办法在实际人体中获取这些EVs。最近已知有许多方法可以从体液中获取EVs,例如超速离心、密度梯度离心或排阻色谱等,而且,如果已确定要分析的目标分子,也可以使用目标特定技术来测量EVs,例如脂质斑点微阵列或免疫捕获方法。EV分离的一个主要挑战之一是需要一定的样本量进行分析,传统的超速离心方法不能用于分析微体积的体液。为了克服这些技术障碍,研究人员提出使用纤维素纳米纤维(CNF)纸(或称为纳米纸)直接从患者微量体液中捕获EVs,甚至在手术中的湿润器官上就可以获取,同时在术后进行分析之前稳定储存EVs。研究人员选择纤维素材料的原因是因为它与经过消毒的纱布具有相同的多糖骨架。纤维素纳米纤维主要源自木细胞壁,因其引人注目的特性而受到广泛关注,包括低密度(1.6 g/cm3)、高强度(2-3 GPa)、大的比表面积(高达800 m2/g)、丰富的羟基基团、强大的吸水性、可持续性、生物相容性和生物降解性。此外,纤维素纳米纤维现在可以在工业操作中大规模生产,预计其市场规模将在2030年达到200亿美元。从纤维素纳米纤维/水分散体开始,可以通过控制纤维素纳米纤维在干燥过程中的排列行为,制备具有可定制纳米结构的纳米纸。纤维素纳米纤维的排列行为以及由此产生的纳米纸的孔隙大小分布可以通过干燥前液体周围液体的表面张力来调整,从而实现纳米纸的孔隙结构的打开和关闭。当在高表面张力的水的存在下制备纳米纸时,所得到的纳米纸具有紧密排列的纳米结构(封闭孔),具有氧气屏障性能。在低表面张力液体的情况下进行干燥而制备的纳米纸具有多孔的纳米结构(开放孔)。然而,至今没有人开发出在多孔纳米纸内捕获大小约40-200纳米的EVs的方法。研究人员构想利用多孔纳米纸的生物相容性和开放孔,直接从人体组织上的体液中捕获EVs,并在干燥后使用闭合的孔和由此产生的氧气屏障性能来存储捕获的EVs。在这项研究中,研究人员定制了多孔纳米纸,称为CNF纸,用于直接从人体组织上的体液中捕获EVs并存储EVs。研究人员根据要捕获的小型EV尺寸设计了孔径大小,并根据可操作性和与人体组织的粘附之间的平衡来设计纸片厚度。CNF纸可以通过简单地附着在湿润组织上,通过毛细力捕获来自10微升体液的EVs。当CNF纸干燥时,由于水的高表面张力,多孔纳米结构会自动关闭。干燥后,CNF纸的封闭孔还可以在室温下至少存储7天,并且可以在磷酸盐缓冲液中释放CNF纸内的EVs。通过使用CNF纸,研究人员捕获了各种EVs,主要是CD63阳性的小型EVs。此外,可以通过使用CNF纸捕获进行小RNA分析来识别EVs中的小RNA。在卵巢癌小鼠模型中,研究人员展示了CNF纸可以在小鼠没有明显腹水的早期阶段检测到肿瘤相关miRNA,并且来自不同位置的EVs具有独特的miRNA谱。通过在患者中进行CNF纸分析,研究发现EV miRNA谱中存在更多基于位置的差异,这些谱反映了疾病情况。研究人员利用CNF纸进行空间外泌体分析,揭示了癌症患者腹水中的EVs表现出依赖位置的异质性。通过在体内使用CNF纸进行分析,该方法揭示了癌症早期进展的腹水EVs的独特特征,以及患者体内EVs的实际基于位置的异质性。这种空间外泌体分析可以为癌症中的EV分离、保存和EV转化生物学提供新的概念。参考文献:Spatial exosome analysis using cellulose nanofiber sheets reveals the location heterogeneity of extracellular vesicles. Nat Commun. 2023 Nov 8;14(1):6915.